Lecture 9: Thermodynamics in Little Details:

- 1. What is thermodynamics?
Answer: Thermodynamics is a branch of physics that deals with heat, work, and temperature and their participation in energy, radiation, and physical properties of materials.

व्याख्यान 9: उष्मागतिकीछोटे विवरण में:
- 1. ऊष्मागतिकी क्या है?
उत्तर: ऊष्मागतिकी भौतिकी की एक शाखा है जो गर्मी, कार्य और तापमान और ऊर्जा, विकिरण और सामग्री के भौतिक गुणों में उनकी भागीदारी से संबंधित है।
Q 2. What is the distinction between mechanics and thermodynamics?
Answer: The difference between mechanics and thermodynamics is a very significantcharacteristic. Mechanics is described as the movement of particles or bodies under the control of forces and torques. While thermodynamics deals with the action of the system as a whole. It is impacted only by the inner macroscopic facts of a substance.
प्रश्न 2. यांत्रिकी और ऊष्मागतिकी में क्या अंतर है?
उत्तर: यांत्रिकी और ऊष्मागतिकी के बीच का अंतर एक बहुत ही महत्वपूर्ण विशेषता है। यांत्रिकी को बलों और टॉर्क के नियंत्रण में कणों या पिंडों की गति के रूप में वर्णित किया गया है। जबकि ऊष्मागतिकी समग्र रूप से प्रणाली की क्रिया से संबंधित है। यह केवल किसी पदार्थ के आंतरिक स्थूल तथ्यों से प्रभावित होता है।
Q 3. How can we classify the various areas of thermodynamics?
Answer: Thermodynamics is divided into the following four fields:
- Classic thermodynamics
- Statistical thermodynamics
- Chemical thermodynamics
- Equilibrium thermodynamics
Classic thermodynamics
In classical thermodynamics, the behavior of matter is analyzed using a macroscopic methodology. Units such as temperature and pressure are taken into account, which benefits people calculate other properties and forecast the properties of the matter go through the procedure.
Statistical Thermodynamics
In statistical thermodynamics, each molecule takes the focus, that is the properties of each molecule and their collaboration are deemed to describe the behavior of a set of molecules.
Chemical Thermodynamics
Chemical thermodynamics deals with the relationship between work and heat in chemical reactions and fluctuations in state.
Equilibrium thermodynamics
Equilibrium thermodynamics is the assessment of conversions of energy and matter as they shift towards stability or equilibrium.
क्यू 3। हम ऊष्मागतिकी के विभिन्न क्षेत्रों को कैसे वर्गीकृत कर सकते हैं?
उत्तर ऊष्मागतिकी को निम्नलिखित चार क्षेत्रों में विभाजित किया गया है:
- क्लासिक थर्मोडायनामिक्स
- सांख्यिकीय ऊष्मागतिकी
- रासायनिक उष्मागतिकी
- संतुलन ऊष्मागतिकी
क्लासिक ऊष्मागतिकी
शास्त्रीय ऊष्मागतिकी में, मैक्रोस्कोपिक पद्धति का उपयोग करके पदार्थ के व्यवहार का विश्लेषण किया जाता है। तापमान और दबाव जैसी इकाइयों को ध्यान में रखा जाता है, जिससे लोगों को अन्य गुणों की गणना करने में लाभ होता है और प्रक्रिया के माध्यम से मामले के गुणों का अनुमान लगाया जाता है।
सांख्यिकीय ऊष्मागतिकी
सांख्यिकीय थर्मोडायनामिक्स में, प्रत्येक अणु फोकस लेता है, यानी प्रत्येक अणु के गुण और उनके सहयोग को अणुओं के एक सेट के व्यवहार का वर्णन करने के लिए समझा जाता है।
रासायनिक ऊष्मागतिकी
रासायनिक ऊष्मागतिकी रासायनिक प्रतिक्रियाओं और राज्य में उतार-चढ़ाव में काम और गर्मी के बीच संबंध से संबंधित है।
संतुलन ऊष्मागतिकी
संतुलन ऊष्मागतिकी ऊर्जा और पदार्थ के रूपांतरण का आकलन है क्योंकि वे स्थिरता या संतुलन की ओर बढ़ते हैं।
Q4. What are the essential beliefs of thermodynamics?
Thermodynamic expressions
Thermodynamics has its particular distinctive dictionary. A nice interpretation of the simple ideas creates a solid awareness of several issues debated in thermodynamics, thereby avoiding possible disagreements.
Thermodynamic Systems
system
A thermodynamic system is a particular part of matter with a certain periphery or boundary to which our interest is concentrated. The system boundary can be true or fictional, fixed, or deformable.
There are three types of systems:
- Isolated system – An isolated or inaccessible system cannot trade energy or mass with its environment. The universe is perceived as an isolated system.
- Closed System – There is transmission of energy but no transmission of mass crossways the border of the closed system. Refrigeration machines, gas compression in the piston-cylinder unit are instances of closed systems.
- Open system – In an open system, both mass and energy can be transmitted among the system and the atmosphere. A steam turbine is an instance of an open system.
Surroundings
Something beyond of the system that has a direct influence on the conduct of the system is known as the atmosphere.
Q4. What are the essential notions of Thermodynamics?
- Isolated System – An isolated or inaccessible system cannot trade both energy and mass with its environments. The universe is deemed an isolated system.
- Closed System – Through the border of the closed system, the transport of energy happens but the transport of mass cannot happen. Examples are the closed systems such as Refrigerator, compression of gas in the piston-cylinder construction.
- Open System – In an open system, the mass and energy both may be transferred between the system and surroundings. A steam turbine is an example of an open system.
- क्यू3बी। ऊष्मागतिकी की आवश्यक मान्यताएँ क्या हैं?
- ऊष्मागतिकी अभिव्यक्ति
- थर्मोडायनामिक्स का अपना विशिष्ट विशिष्ट शब्दकोश है। सरल विचारों की एक अच्छी व्याख्या ऊष्मागतिकी में बहस किए गए कई मुद्दों के बारे में एक ठोस जागरूकता पैदा करती है, जिससे संभावित असहमति से बचा जा सकता है।
- थर्मोडायनामिक सिस्टम
- प्रणाली
- एक थर्मोडायनामिक प्रणाली एक निश्चित परिधि या सीमा के साथ पदार्थ का एक विशेष हिस्सा है जिसमें हमारी रुचि केंद्रित होती है। सिस्टम की सीमा सही या काल्पनिक, स्थिर या विकृत हो सकती है।
- तीन प्रकार के सिस्टम हैं:
- पृथक प्रणाली – एक पृथक या दुर्गम प्रणाली अपने पर्यावरण के साथ ऊर्जा या द्रव्यमान का व्यापार नहीं कर सकती है। ब्रह्मांड को एक पृथक प्रणाली के रूप में माना जाता है।
- बंद प्रणाली – ऊर्जा का संचरण होता है लेकिन बंद प्रणाली की सीमा के पार बड़े पैमाने पर संचरण नहीं होता है। प्रशीतन मशीन, पिस्टन-सिलेंडर इकाई में गैस संपीड़न बंद सिस्टम के उदाहरण हैं।
बंद प्रणाली की सीमा के माध्यम से, ऊर्जा का परिवहन होता है लेकिन द्रव्यमान का परिवहन नहीं हो सकता है। उदाहरण बंद प्रणालियाँ हैं जैसे कि फ्रिज, पिस्टन-सिलेंडर निर्माण में गैस का संपीड़न।
- खुली प्रणाली – एक खुली प्रणाली में, प्रणाली और वातावरण के बीच द्रव्यमान और ऊर्जा दोनों का संचार किया जा सकता है। एक भाप टरबाइन एक खुली प्रणाली का एक उदाहरण है।
- परिवेश
- सिस्टम से परे कुछ जो सिस्टम के आचरण पर सीधा प्रभाव डालता है उसे वायुमंडल के रूप में जाना जाता है
Q 5 What are the various thermodynamic procedures?
A system is experiencing a thermodynamic procedureonce an energetic variationhappensinside the system that is coupled with fluctuations in pressure, volume, and itsinner energy.
Normally we can say that four types of thermodynamic processes are possible that have their distinctivecharacteristics such as:
- Adiabatic Process –It is a kind of procedure in which there is no heat transmissioninside or outside of the system.
- Isochoric Process – It is a kind of procedure in which no volume shifthappens while the system is not under operation.
- Isobaric Process – It is a kind of procedure in which no pressure shifthappens.
- Isothermal Process –This is process or procedure in which no temperature shifthappens.
We can just claim a thermodynamic phase is a process or pattern of processes accomplished in such a sense that the opening and closing states of the system are the identical. A thermodynamic cycle is also described to as cycle function or cycle processes.
प्रश्न 5 विभिन्न थर्मोडायनामिक प्रक्रियाएं क्या हैं?
एक बार सिस्टम के अंदर एक ऊर्जावान बदलाव होता है जो दबाव, मात्रा और इसकी आंतरिक ऊर्जा में उतार-चढ़ाव के साथ मिलकर एक थर्मोडायनामिक प्रक्रिया का अनुभव कर रहा है।
आम तौर पर हम कह सकते हैं कि चार प्रकार की थर्मोडायनामिक प्रक्रियाएं संभव हैं जिनकी अपनी विशिष्ट विशेषताएं हैं जैसे:
ए। रुद्धोष्म प्रक्रिया – यह एक प्रकार की प्रक्रिया है जिसमें प्रणाली के अंदर या बाहर कोई ऊष्मा संचरण नहीं होता है।
बी। आइसोकोरिक प्रक्रिया – यह एक तरह की प्रक्रिया है जिसमें सिस्टम के संचालन के दौरान कोई वॉल्यूम शिफ्ट नहीं होता है।
सी। समदाब रेखीय प्रक्रिया – यह एक प्रकार की प्रक्रिया है जिसमें कोई दाब परिवर्तन नहीं होता है।
डी। इज़ोटेर्मल प्रक्रिया – यह प्रक्रिया या प्रक्रिया है जिसमें कोई तापमान परिवर्तन नहीं होता है।
हम केवल यह दावा कर सकते हैं कि थर्मोडायनामिक चरण एक प्रक्रिया या प्रक्रियाओं का पैटर्न है जो इस तरह से पूरा किया जाता है कि सिस्टम के उद्घाटन और समापन राज्य समान होते हैं। एक थर्मोडायनामिक चक्र को चक्र कार्य या चक्र प्रक्रियाओं के रूप में भी वर्णित किया जाता है।
Q 6. What is thermodynamic equilibrium?
In a given state, all properties of a system mustcorrect values. Therefore, if the value of even single property shifts, the state of the system shifts to a new. In a system that is in balance or equilibrium, no fluctuations in the value of properties happen when it is isolated from its atmosphere.
- It should be noted that if the temperature is the similarduring the system, we call that system that it is in thermal balance or equilibrium.
- It should be also noted that if no pressure change happensanyplace in the system, we can callsuch system to be in mechanical balance or equilibrium.
- If on the other hand chemical structure of a system does not shiftacrosstime, we call the system as in chemical equilibrium.
- Surrounding
- While is very essential to note that allbeyond the system that has a directlyimpact on the performance of the system is called as a surrounding.
- प्रश्न उष्मागतिकी संतुलन क्या है?
- किसी दिए गए राज्य में, सिस्टम के सभी गुणों को मानों को सही करना चाहिए। इसलिए, यदि एकल संपत्ति का मूल्य भी बदल जाता है, तो सिस्टम की स्थिति एक नए में बदल जाती है। एक ऐसी प्रणाली में जो संतुलन या संतुलन में है, गुणों के मूल्य में कोई उतार-चढ़ाव नहीं होता है जब इसे अपने वातावरण से अलग किया जाता है।
- ए। यह ध्यान दिया जाना चाहिए कि यदि सिस्टम के दौरान तापमान समान है, तो हम उस सिस्टम को कहते हैं कि यह थर्म में है
- Q 7. What is the Thermodynamic Equilibrium?
- At a certain state, the entire properties of a system have their stable values. Therefore, if the value of yet one property shifts, the state of the system shifts to another value. In a system that is in equilibrium or balance, no fluctuations in the value of properties happenonce it is separated or isolated from its environments.
- When the temperature is the similarall over the whole system, we believe the system should be in thermal equilibrium.
- When there is no shift in pressure at any moment of the system, we believe the system should be in mechanical equilibrium.
- When the chemical structure of a system cannotfluctuate with time, we believe that the system should be in chemical equilibrium.
- While phase equilibrium in a double-phase system is when the mass of every phase achieves an equilibrium point.
- It should be noted that a thermodynamic system is supposed to be in thermodynamic equilibrium if it is in chemical equilibrium, mechanical equilibrium and thermal equilibrium and the appropriatefactorsterminate to fluctuate with time.
प्रश्न 7. थर्मोडायनामिक संतुलन क्या है?
एक निश्चित अवस्था में, सिस्टम के संपूर्ण गुणों का अपना स्थिर मान होता है। इसलिए, यदि अभी तक एक संपत्ति का मूल्य बदल जाता है, तो सिस्टम की स्थिति दूसरे मूल्य में बदल जाती है। एक ऐसी प्रणाली में जो संतुलन या संतुलन में है, गुणों के मूल्य में कोई उतार-चढ़ाव नहीं होता है जब यह अपने वातावरण से अलग या अलग हो जाता है।
- जब तापमान पूरे सिस्टम में समान होता है, तो हम मानते हैं कि सिस्टम थर्मल संतुलन में होना चाहिए।
- जब सिस्टम के किसी भी क्षण दबाव में कोई बदलाव नहीं होता है, तो हम मानते हैं कि सिस्टम यांत्रिक संतुलन में होना चाहिए।
- जब किसी प्रणाली की रासायनिक संरचना समय के साथ नहीं बदल सकती है, तो हम मानते हैं कि प्रणाली रासायनिक संतुलन में होनी चाहिए।
- जबकि एक दोहरे चरण प्रणाली में चरण संतुलन तब होता है जब प्रत्येक चरण का द्रव्यमान एक संतुलन बिंदु प्राप्त करता है।
यह ध्यान दिया जाना चाहिए कि एक थर्मोडायनामिक प्रणाली को थर्मोडायनामिक संतुलन में माना जाता है यदि यह रासायनिक संतुलन, यांत्रिक संतुलन और थर्मल संतुलन में है और उपयुक्त कारक समय के साथ उतार-चढ़ाव के लिए समाप्त हो जाते हैं।
Q 8. How can we define the Thermodynamic Properties?
Thermodynamic properties are described as distinctiveaspects of a system, efficient of identifying the system’s state. Thermodynamic properties may be vast or rigorous.
Intensive properties are properties that do not fluctuate on the amount of matter. Examples are pressure and temperature as the intensive properties.
In the instance of vast properties, their value varies on the mass of the system. Examples of extensive properties are the Volume, energy, and enthalpy.
प्रश्न 8. हम थर्मोडायनामिक गुणों को कैसे परिभाषित कर सकते हैं?
थर्मोडायनामिक गुणों को सिस्टम के विशिष्ट पहलुओं के रूप में वर्णित किया जाता है, जो सिस्टम की स्थिति की पहचान करने में कुशल होते हैं। थर्मोडायनामिक गुण विशाल या कठोर हो सकते हैं।
गहन गुण वे गुण हैं जो पदार्थ की मात्रा पर उतार-चढ़ाव नहीं करते हैं। गहन गुणों के रूप में उदाहरण दबाव और तापमान हैं।
विशाल गुणों के उदाहरण में, उनका मूल्य प्रणाली के द्रव्यमान पर भिन्न होता है। व्यापक गुणों के उदाहरण आयतन, ऊर्जा और थैलीपी हैं।
Q 9.What can define the Enthalpy?
Enthalpy may be defined as the quantity of energy in a thermodynamic system. The amount of enthalpy amount to the aggregate heat content of a system, equivalent to the internal energy of a system added with the multiplication of volume and pressure.
Systematically, the enthalpy, H, amount to the sum total of the internal energy E and the multiplication of P (pressure) and V (volume) of a given system; that is
H = E + PV
क्यू 9। एन्थैल्पी को क्या परिभाषित कर सकता है?
एन्थैल्पी को थर्मोडायनामिक प्रणाली में ऊर्जा की मात्रा के रूप में परिभाषित किया जा सकता है। एक प्रणाली की कुल गर्मी सामग्री के लिए थैलेपी राशि की मात्रा, मात्रा और दबाव के गुणन के साथ जोड़े गए सिस्टम की आंतरिक ऊर्जा के बराबर होती है।
वैज्ञानिक रूप से, एन्थैल्पी, एच, आंतरिक ऊर्जा E के कुल योग और किसी दिए गए सिस्टम के P (दबाव) और V (वॉल्यूम) के गुणन के बराबर है; अर्थात्
H = E + PV
Q 10. How can we describe the Entropy?
The entropy may be described as the thermodynamic quantity whose value cantered on the physical state or form of a system. Otherwise, it is a function of thermodynamicsused to ascertain the instability or disorder.
Example is the entropy of a solid wherever the particles are not allowed to move about, is fewer than the entropy of a gas in which case the particles will load the vessel in which they occupy.
क्यू 10। हम एन्ट्रापी को कैसे परिभाषित कर सकते हैं?
एन्ट्रापी को थर्मोडायनामिक राशि के रूप में परिभाषित किया जा सकता है जिसका मूल्य भौतिक अवस्था या सिस्टम के रूप पर आधारित होता है। वैकल्पिक रूप से, यह थर्मोडायनामिक्स का एक कार्य है जिसका उपयोग अप्रत्याशितता या विकार को निर्धारित करने के लिए किया जाता है।
उदाहरण एक ठोस की एन्ट्रापी है जहाँ कणों को इधर-उधर जाने की अनुमति नहीं है, यह गैस की एन्ट्रापी से कम है जिस स्थिति में कण उस बर्तन को लोड करेंगे जिसमें वे रहते हैं।
- 11.How can we describe the Thermodynamic Potentials?
Thermodynamic potentials are described as the mathematicalamounts of the collected energy in a system. Potentials define the energy differences in a system as they go on from early state to final state. Focussed on the system restrictions, such as temperature and pressure, several potentials are employed.
Variouskinds of thermodynamic potentials along with their correspondingformula are givenas:
| Internal Energy | U |
| Helmholtz free energy | F = U – TS |
| Enthalpy | H = U + PV |
| Gibbs Free Energy | G |
प्रश्न 11. हम थर्मोडायनामिक क्षमता को कैसे परिभाषित कर सकते हैं?
थर्मोडायनामिक क्षमता को एक प्रणाली में संचित ऊर्जा की संख्यात्मक मात्रा के रूप में परिभाषित किया गया है। क्षमताएं एक प्रणाली में ऊर्जा भिन्नताओं को निर्धारित करती हैं क्योंकि वे प्रारंभिक अवस्था से अंतिम अवस्था तक जाती हैं। तापमान और दबाव जैसे सिस्टम की सीमाओं पर केंद्रित, विभिन्न क्षमताएं कार्यरत हैं।
उनके संबंधित सूत्र के साथ विभिन्न प्रकार की थर्मोडायनामिक क्षमताएं इस प्रकार प्रस्तुत की जाती हैं:
आंतरिक ऊर्जा यU
हेल्महोल्ट्ज़ मुक्त ऊर्जा F = U – TS
एन्थैल्पी एच = U + PV
गिब्स फ्री एनर्जी G
- 12. What can we describe the Laws of Thermodynamics ?
Thermodynamics laws identify the essential physical quantities as energy, temperature and entropy that describe thermodynamic systems at thermal equilibrium. Such laws of thermodynamics indicateprecisely howsuch quantities behave under numerouscircumstances.
प्रश्न 11. ऊष्मागतिकी के नियमों का हम क्या वर्णन कर सकते हैं?
थर्मोडायनामिक्स कानून बुनियादी भौतिक मात्राओं को ऊर्जा, तापमान और एन्ट्रॉपी के रूप में निर्दिष्ट करते हैं जो थर्मल संतुलन पर थर्मोडायनामिक सिस्टम का वर्णन करते हैं। ऊष्मागतिकी के ऐसे नियम यह दर्शाते हैं कि ऐसी मात्राएँ कई स्थितियों में कैसे कार्य करती हैं।
- 13. How much laws of thermodynamics exist?Describe.
We can define four laws of thermodynamics which are statedas:
Zeroth law of thermodynamics
First law of thermodynamics
Second law of thermodynamics
Third law of thermodynamics
- 13. ऊष्मागतिकी के कितने नियम मौजूद हैं? वर्णन करना।
हमारे पास ऊष्मागतिकी के चार नियम हैं जिनका उल्लेख इस प्रकार है:
ऊष्मागतिकी का ज़ीरोथ नियम
ऊष्मागतिकी का पहला नियम
ऊष्मागतिकी का दूसरा नियम
ऊष्मागतिकी का तीसरा नियम
Q 14. Describe the Zeroth law of thermodynamics and provide its appropriate example.
Zeroth Law of Thermodynamics:
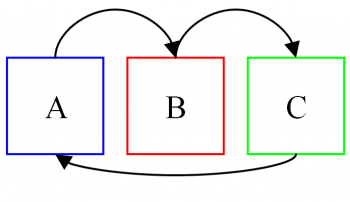
The Zeroth law of thermodynamics states that if two bodies are separately in equilibrium with a separate third body, then the first two bodies are also in thermal equilibrium with each other.
This implies that if system A is in thermal equilibrium with system C and system B is likewise in equilibrium with system C, then system A and B are as well in thermal equilibrium.
प्रश्न 14. उष्मागतिकी के ज़ीरोथ नियम का वर्णन करें और इसका उपयुक्त उदाहरण प्रदान करें।
ऊष्मागतिकी का शून्य नियम:
उष्मागतिकी के ज़ीरोथ नियम में कहा गया है कि यदि दो निकाय अलग-अलग तीसरे शरीर के साथ व्यक्तिगत रूप से संतुलन में हैं, तो पहले दो निकाय भी एक दूसरे के साथ तापीय संतुलन में हैं।
इसका मतलब यह है कि यदि सिस्टम ए सिस्टम सी के साथ थर्मल संतुलन में है और सिस्टम बी भी सिस्टम सी के साथ संतुलन में है, तो सिस्टम ए और बी भी थर्मल संतुलन में हैं।
Q 15. What is the instance of Zeroth law of thermodynamics in everyday life?
Anexcitinginstancedescribing the Zeroth Law is:
Thermodynamics Illustrations in EverydayNatural life states may be very useful to understand it.
Whether we are resting in an air-conditioned area or moving in any car, the use of thermodynamics is all over. Some of them beingcatalogued as below:
Severalkinds of vehicles for example planes, buses and ships operatebased on the second law of thermodynamics.
We have the three methods of heat transmission work based on thermodynamics. The heat transmissiontheories are commonlyemployed in radiators, heaters and coolers.
Thermodynamics is engaged in the analysis of variouskinds of fuel plants such as nuclear power plants, thermal power plants etc.
Q 15. दैनिक जीवन में उष्मागतिकी के ज़ीरोथ नियम का उदाहरण क्या है?
ज़ीरोथ कानून की व्याख्या करने वाला एक दिलचस्प उदाहरण है:
रोजमर्रा की प्राकृतिक जीवन अवस्थाओं में थर्मोडायनामिक्स चित्र इसे समझने के लिए बहुत उपयोगी हो सकते हैं।
चाहे हम वातानुकूलित क्षेत्र में आराम कर रहे हों या किसी कार में घूम रहे हों, थर्मोडायनामिक्स का उपयोग खत्म हो गया है। उनमें से कुछ को नीचे सूचीबद्ध किया जा रहा है:
ऊष्मागतिकी के दूसरे नियम के आधार पर कई प्रकार के वाहन, उदाहरण के लिए विमान, बस और जहाज संचालित होते हैं।
हमारे पास ऊष्मागतिकी पर आधारित ऊष्मा संचरण कार्य की तीन विधियाँ हैं। गर्मी संचरण सिद्धांत आमतौर पर रेडिएटर, हीटर और कूलर में नियोजित होते हैं।
थर्मोडायनामिक्स विभिन्न प्रकार के ईंधन संयंत्रों जैसे परमाणु ऊर्जा संयंत्र, थर्मल पावर प्लांट आदि के विश्लेषण में लगा हुआ है।
Q 16: What is the common significance of the laws of thermodynamics?
The laws of thermodynamics describe physical quantities like temperature, energy & entropy that describe thermodynamic systems which are under thermal equilibrium.
प्रश्न 16: ऊष्मागतिकी के नियमों का सामान्य महत्व क्या है?
ऊष्मागतिकी के नियम तापमान, ऊर्जा और एन्ट्रापी जैसी भौतिक मात्राओं का वर्णन करते हैं जो थर्मोडायनामिक प्रणालियों का वर्णन करते हैं जो थर्मल संतुलन के तहत हैं।
Q 17: How can we describe an example of negative work?
Oncewe push an itemdown the floor then the work done is negative as a result of Kinetic Friction.
प्रश्न 17: हम नकारात्मक कार्य के उदाहरण का वर्णन कैसे कर सकते हैं?
एक बार जब हम किसी वस्तु को फर्श से नीचे धकेलते हैं तो काइनेटिक घर्षण के परिणामस्वरूप किया गया कार्य ऋणात्मक होता है।
Q 18: Is it possible that energy be destroyed or lost?
Energy can never neither be produced nor be destroyed, it can just be transportedas of one kind to a new.
प्रश्न 18: क्या यह संभव है कि ऊर्जा नष्ट हो जाए या नष्ट हो जाए?
ऊर्जा को न तो कभी उत्पादित किया जा सकता है और न ही नष्ट किया जा सकता है, इसे केवल एक प्रकार से नए में पहुँचाया जा सकता है।
Q 19: Fans transform electric power into mechanical power, which law explain it?
This may be clarified by the application of first law of thermodynamics.
Q 19: पंखे विद्युत शक्ति को यांत्रिक शक्ति में बदलते हैं, इसे कौन सा नियम समझाता है?
इसे ऊष्मागतिकी के प्रथम नियम के अनुप्रयोग द्वारा स्पष्ट किया जा सकता है।
Q 20: Can we claim that human body comply with the thermodynamics laws?
Yes, we can. Because the human body respects the law of thermodynamics. When we are in a filled room with morepersons, westart to be feelinghot, and westart to worry. This is the attitude of the body to cool down itself. Actually, what turn out that heat from the body is transported to the sweat. As the sweat graspsextra heat, it evaporates from our body, turn out to be more disorganized and transferring heat to the atmosphere, which heats the room at the air temperature.
If there is closed room and having numerous people, then location will be instantly heated up which describes the laws of thermodynamics together first and second. No means heat is fatigued; it is simplytransported and enhances equilibrium with extreme entropy.
प्रश्न 20: क्या हम यह दावा कर सकते हैं कि मानव शरीर ऊष्मागतिकी के नियमों का पालन करता है?
हाँ हम कर सकते हैं। क्योंकि मानव शरीर ऊष्मागतिकी के नियम का पालन करता है। जब हम अधिक व्यक्तियों के साथ भरे हुए कमरे में होते हैं, तो हमें गर्मी लगने लगती है, और हमें चिंता होने लगती है। यह शरीर का स्वयं को ठंडा करने का तरीका है। दरअसल, ऐसा क्या होता है कि शरीर से निकलने वाली गर्मी पसीने में पहुंच जाती है। जैसे ही पसीना अतिरिक्त गर्मी को पकड़ लेता है, यह हमारे शरीर से वाष्पित हो जाता है, अधिक अराजक हो जाता है और वातावरण में गर्मी संचारित करता है, जो कमरे के हवा के तापमान को गर्म करता है।
यदि कमरा बंद है और बहुत से लोग हैं, तो स्थान जल्दी से गर्म हो जाएगा जो पहले और दूसरे दोनों में थर्मोडायनामिक्स के नियमों की व्याख्या करता है। किसी भी तरह से गर्मी समाप्त नहीं होती है; यह आसानी से स्थानांतरित हो जाता है और अधिकतम एन्ट्रापी के साथ संतुलन में सुधार करता है।
Q 21. What are the laws of THERMODYNAMICS?
Answer Q 21. We have four laws thermodynamics these are the extremelyvital laws of physics. These laws are defining as:
- Zeroth law of thermodynamics states that if two systems of thermodynamics are each one in thermal equilibrium along with a third then off course, they should be in thermal equilibrium with each other.
- 1st law of thermodynamics states that Energy can neither be produced nor demolished while it can justshift from one form to another form. It means during any process; the entire energy of this universe stays the identical. For any cycle of thermodynamic the overall heat delivered to the system amount to the overall work performedthrough the system.
- 2nd law of thermodynamics defines thatthe entropy of any system which is isolatedor alone not in equilibrium will be likely to riseacross time which approaches a highestamount at the equilibrium.
- Third law of thermodynamics says thatas temperature move towards absolute zero temperature then the entropy of a given system move towards a constant lowest value.
Q 22. What are the Systems and surroundings?
- Ans 22: When we talk of Biology, then thermodynamics indicatesit is the study of energy transmissions that happen in molecules or groups of molecules. While we are thinking of thermodynamics, the specificpiece or collection of pieces is known as the system, on the other handthe whole thingwhich are not the part of the system is defined as the the surroundings.
Q 23. How many types of the systems in thermodynamics are possible?
Answer 23: There are total three types of the systems and they are the
open, closed, and isolated system.
Q 24. Define the three types of the systems in the thermodynamics?
- An open system is a system that can interchangetogether energy and matter together with surroundings of its own. The example is the stovetop that would be an open system since heat and water vapor both can be wastedinto the air. Another example is the example is an open cup of coffee.
- A closed system is the systemin contrast that can interchangejust energy with surroundings of its own while it cannot exchangethe matter. Example is a cup of coffee with a top on it or another example isa water bottle.
- An isolated system is the system that cannot interchangeany matter or energy with surroundings of its own. Anideal isolated system is difficultto quote, however, an A closed thermos bottle or a sealed vacuum flask is essentially an isolated system if the real exceptions are avoided.
- Q 25: What is the example of the first law of thermodynamics?
The first law of thermodynamics says that total amount of energy in the universe, and it states that this total amount does not change. Examples are:
- Simple example is that light bulbs convert electrical energy into light energy which is called the radiant energy.
- One pool ball hit another balltransporting its kinetic energy and getting the second ball to cause move.
प्रश्न 21. थर्मोडायनामिक्स के नियम क्या हैं?
उत्तर Q 21. हमारे पास चार नियम हैं ऊष्मागतिकी ये भौतिकी के अत्यंत महत्वपूर्ण नियम हैं। ये कानून इस प्रकार परिभाषित कर रहे हैं:
- ऊष्मागतिकी का ज़ीरोथ नियम कहता है कि यदि ऊष्मागतिकी की दो प्रणालियाँ ऊष्मीय संतुलन में एक के साथ-साथ एक हैं तो निश्चित रूप से, वे एक दूसरे के साथ तापीय संतुलन में होनी चाहिए।
- ऊष्मागतिकी का पहला नियम कहता है कि ऊर्जा का न तो उत्पादन किया जा सकता है और न ही नष्ट किया जा सकता है, जबकि यह केवल एक रूप से दूसरे रूप में स्थानांतरित हो सकता है। इसका मतलब है किसी भी प्रक्रिया के दौरान; इस ब्रह्मांड की सारी ऊर्जा एक समान रहती है। थर्मोडायनामिक के किसी भी चक्र के लिए सिस्टम को दी गई समग्र गर्मी सिस्टम के माध्यम से किए गए समग्र कार्य के बराबर होती है।
- ऊष्मागतिकी का दूसरा नियम परिभाषित करता है कि किसी भी प्रणाली की एन्ट्रापी जो अलग है या अकेले संतुलन में नहीं है, समय के साथ बढ़ने की संभावना होगी जो संतुलन पर उच्चतम राशि तक पहुंचती है।
- ऊष्मागतिकी का तीसरा नियम कहता है कि जब तापमान परम शून्य तापमान की ओर बढ़ता है तो किसी दिए गए सिस्टम की एन्ट्रापी एक स्थिर न्यूनतम मान की ओर बढ़ती है।
प्रश्न 22. सिस्टम और परिवेश (surrounding) क्या हैं?
प्रश्न 22: जब हम जीव विज्ञान की बात करते हैं, तो थर्मोडायनामिक्स इंगित करता है कि यह अणुओं या अणुओं के समूहों में होने वाले ऊर्जा संचरण का अध्ययन है। जबकि हम थर्मोडायनामिक्स के बारे में सोचते हैं, विशिष्ट टुकड़े या टुकड़ों के संग्रह को सिस्टम के रूप में जाना जाता है, दूसरी ओर पूरी चीज जो सिस्टम का हिस्सा नहीं है उसे परिवेश के रूप में परिभाषित किया जाता है।
प्रश्न 23. थर्मोडायनामिक्स में कितने प्रकार के सिस्टम संभव हैं?
उत्तर 23: प्रणालियाँ कुल तीन प्रकार की होती हैं और वे हैं
खुली, बंद और पृथक प्रणाली।
Q 24. ऊष्मागतिकी में तीन प्रकार की प्रणालियों को परिभाषित करें?
- खुली प्रणाली एक ऐसी प्रणाली है जो ऊर्जा और पदार्थ को अपने आसपास के वातावरण के साथ आपस में बदल सकती है। उदाहरण स्टोवटॉप है जो एक खुली प्रणाली होगी क्योंकि गर्मी और जल वाष्प दोनों हवा में बर्बाद हो सकते हैं। एक अन्य उदाहरण उदाहरण है एक खुला कप कॉफी।
- एक बंद प्रणाली इसके विपरीत प्रणाली है जो केवल ऊर्जा को अपने परिवेश के साथ बदल सकती है जबकि यह पदार्थ का आदान-प्रदान नहीं कर सकती है। उदाहरण एक कप कॉफी है जिसके ऊपर शीर्ष है या दूसरा उदाहरण पानी की बोतल है।
- एक पृथक प्रणाली वह प्रणाली है जो किसी भी पदार्थ या ऊर्जा को अपने परिवेश के साथ नहीं बदल सकती है। एक आदर्श पृथक प्रणाली को उद्धृत करना मुश्किल है, हालांकि, एक बंद थर्मस बोतल या एक सीलबंद वैक्यूम फ्लास्क अनिवार्य रूप से एक पृथक प्रणाली है यदि वास्तविक अपवादों से बचा जाता है।
प्रश्न 25: ऊष्मागतिकी के प्रथम नियम का उदाहरण क्या है?
ऊष्मागतिकी का पहला नियम कहता है कि ब्रह्मांड में ऊर्जा की कुल मात्रा है, और यह बताता है कि यह कुल राशि नहीं बदलती है। उदाहरण हैं:
- सरल उदाहरण यह है कि प्रकाश बल्ब विद्युत ऊर्जा को प्रकाश ऊर्जा में परिवर्तित करते हैं जिसे विकिरण ऊर्जा कहा जाता है।
- एक पूल बॉल दूसरी गेंद से टकराती है जो अपनी गतिज ऊर्जा को ले जाती है और दूसरी गेंद को हिलाने के लिए प्रेरित करती है।